Aguas Cerveceras

Cuando disfrutamos de una de nuestras cervezas favoritas, es fácil apreciar los sabores del lúpulo y las maltas, el carácter determinante de la levadura usada o las notas distintivas de algún paso por barrica, pero probablemente jamás repararemos en el agua, percatándonos, por ejemplo, que sus iones sulfato resaltan el amargor de los lúpulos, o que el color dorado y el delicado amargo de una Pilsner se deben a su blandura. El agua es a menudo pasado por alto, pero por ser el ingrediente más abundante en la cerveza (entre el 85 y 92% ), sin duda, desempeña un papel importante en la determinación de su sabor, su aroma y su color . Tanto es así que hay casos en los que, sólo las diferencias en la composición del agua, distinguen un estilo de otro.
Históricamente, conscientes de la importancia de esta materia prima, las fábricas de cerveza se instalaron siempre próximas a ríos o manantiales importantes, asegurándose así un suministro permanente de agua, de buena calidad y de características constantes..
Los intentos de reproducir sus cervezas en un lugar diferente hicieron que el sabor original de las mismas se perdiera y, en muchos casos descartaron esa posibilidad hasta que, por medios artificiales, pudieron obtener un agua similar a la del lugar de origen..
Si bien hoy, hay todavía algunas cervecerías que cuentan con una fuente propia, la mayoría hace uso del agua de red y mediante sistemas de tratamiento físico-químicos logran imitar cualquier tipo de agua, manteniendo las características originales de sus cervezas, permitiéndoles, además, elaborar la misma receta en cualquier lugar del mundo….
TIPOS
 Hasta entrado el siglo XIX, los cerveceros no entendían muy bien el efecto del agua en la producción de cerveza, pero sabían que las aguas de ciertas zonas eran mejores para la elaboración de determinados estilos.
Hasta entrado el siglo XIX, los cerveceros no entendían muy bien el efecto del agua en la producción de cerveza, pero sabían que las aguas de ciertas zonas eran mejores para la elaboración de determinados estilos.
Los estilos clásicos que hoy conocemos son, en gran parte, el producto de las características del agua local en las ciudades donde nacieron, se consolidaron y se hicieron famosos.
Los más fundamentalistas decían, en una época, que era imposible elaborar una Porter sin el agua del Thames en Londres. Afortunadamente las cosas cambian y hoy no es tan así.
Podríamos decir que, químicamente, el agua es H2O, dos átomos de hidrógeno y uno de oxígeno, pero en la práctica es mucho más que eso, es H2O más una gran cantidad de minerales, materia orgánica y gases disueltos.
Todos conocemos cual es el ciclo del agua en la naturaleza, en un principio cae pura, en forma de lluvia, granizo o nieve y, en su camino hacia la tierra, se disuelven en ella gases, como el oxígeno y el CO2, y otras partículas provenientes de la atmósfera. Una vez sobre la tierra comienza a escurrirse hacia napas y pozos subterráneos o bien a correr hacia distintas fuentes como ríos, arroyos y lagos. En su carrera hacia esos destinos, el agua va tomando algo de cada lugar por donde pasa, de la tierra, de la arena, de las piedras, y va formando un perfil que al final le dará su identidad y en ocasiones la hará única.
En áreas donde las rocas son duras, por ejemplo, el agua no penetrará profundamente y será “blanda” (que es baja en sales disueltas). En cambio, en donde las rocas son más permeables ( yeso o piedra caliza), el agua penetra más fácilmente y disuelve muchos minerales llegando a los reservorios como agua “dura”.
Ejemplos hay muchos, el bajo contenido de sales disueltas en el agua de Bohemia la hace ideal para obtener el sabor característico de las Lagers de esa zona; la abundancia de minerales, como el calcio, en las aguas de Burton-on-Trent las hace especiales para las Pale Ales o el caso de las aguas de Londres y Dublín, ricas en cloruro, que resultan ideales para la elaboración de Porters y Stouts. Por último, hay zonas donde las características del agua puede cambiar dependiendo de la estación del año, por ejemplo en primavera las fuentes se llenan con las aguas provenientes de la nieve derretida siendo muy suave, mientras que en verano y otoño se recurre a embalses teniendo así aguas con más sales disueltas. Hay caso también donde la obtención de agua sólo es posible recolectando lluvia, como ser en la isla de Malta donde las cerveza tienen un sabor muy característico.
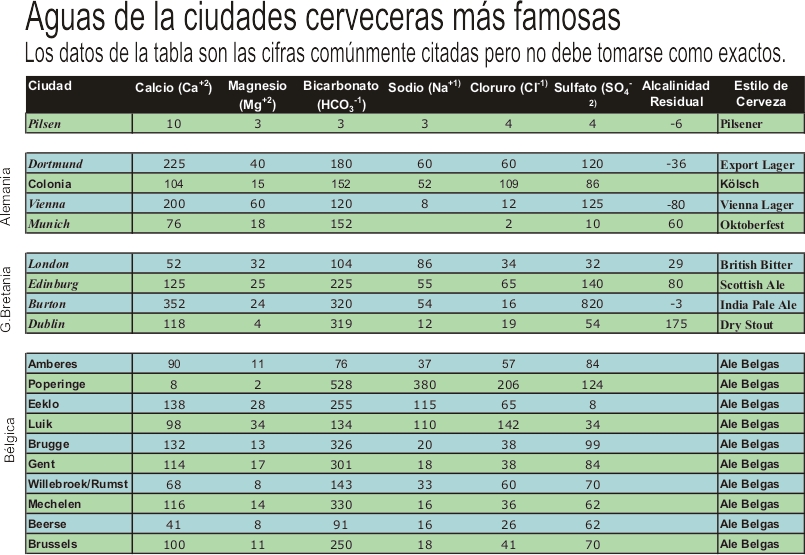
Pilsen
Es un agua de dureza y alcalinidad muy bajas, proveniente de Pilsen (Plzen), ciudad ubicada al oeste de la región de Bohemia, en la República Checa.
Los niveles, también bajos de sodio, cloruro y sulfatos le dan un perfil general blando, logrando en el macerado un pH óptimo con el sólo uso de maltas base. La escasez de sulfato equilibra el amargor y realza el aroma de los lúpulos.
Dortmund
Con niveles altos de alcalinidad total y dureza permanente, el agua de esta ciudad situada en la Renania del Norte-Westfalia, Alemania, produce espléndidas lagers rubias, con menos carácter a lúpulo que la de Pilsen. Una mayor presencia de minerales, en especial sulfatos, favorece el sabor de la malta y la hace similar al agua de Vienna, pero las cervezas logradas son más rotundas, seca y de color más claro.
Vienna
Similar a la anterior, el agua de la capital de Austria, no tiene el nivel de calcio necesario para balancear los carbonatos, y cuenta con mucho menos sodio y cloruros que la de Dortmund. En un principio hubo intentos de imitar las cervezas de esa ciudad alemana pero no se logró balancear el macerado hasta que se agregó un porcentaje de maltas tostadas. Fue así que nacieron las famosas lager rojo-ambar de Vienna. Una concentración bastante alta de sulfato acentúa el tostado de las maltas y contribuye a la obtención de un final seco…
Munich
Situada en la región de Baviera, esta ciudad dispone de un suministro de agua con un contenido alto en carbonatos y moderado en la mayoría de los otros minerales.
Para balancear los carbonatos y hacer más ácida la maceración, las cervecerías optaron por el uso de maltas especiales mas oscuras en sus cervezas, obteniendo un perfil más malteado. Esto último se ve favorecido por el bajo nivel de sulfatos del agua local que, a su vez, equilibra el amargor de los lúpulos. Así nacieron las Dunkels, las Bocks, y las Oktoberfests, famosas por sus suaves aromas.
Londres
Hoy en Londres, capital de Inglaterra, las aguas varían dependiendo del distrito, pero un agua clásica de esa ciudad debe poseer niveles bajos en calcio y altos en carbonatos y sodio.
La característica demasiada alcalina de esta agua dificulta la elaboración de las cervezas más claras, pero es perfecta para producir Porter y otras ales más oscuras. Las maltas tostadas utilizadas en estas cervezas, naturalmente ácidas, logran bajar el pH del mash al rango correcto. Por otro lado, el sodio acentúa la maltosidad y suaviza el aroma, haciendo únicas las Porter de Londres.
Edinburg
El agua de esta ciudad, capital de Escocia, es similar a la de Londres pero con un nivel de bicarbonato y sulfato más alto. Esto hace que las cervezas elaboradas en esta parte del mundo puedan ser pensadas con una maltosidad más definida y que puedan ser equilibradas usando una cantidad menor de lúpulo.
Burton-on-Trent
En esta ciudad, ubicada en el centro de Inglaterra, encontramos un agua con niveles de calcio y magnesio notablemente altos. Esto sería perjudicial para la maceración sino fuera que contiene además la cantidad necesaria de carbonatos para balancear los efectos negativos en el mash. La relación dureza-alcalinidad, es muy similares a los niveles del agua de Pilsen, pudiendo lograr cervezas mas claras. El alto nivel de sulfato y el sodio bajo realzan todas las características del lúpulo produciendo un amargor limpio y definido
Dublín
Capital de la República de Irlanda, Dublín es famosa por sus Stouts.. Con un alto contenido de calcio y la mayor concentración de carbonatos en todas las islas Británicas, su agua es muy adecuada para el uso de grandes cantidades de maltas oscuras y altamente ácidas. Esto último hizo posible que, en esta ciudad irlandesa, se puedan producir las cervezas más oscuras del mundo.
Los niveles bajos de sodio, clorato y sulfato logran que lúpulo aporte un amargor adecuado para balancear toda la malta.
Argentina
En países extensos como Argentina seguramente hay muchos lugares con aguas cerveceras óptimas y con características distintas unas de las otras. Muchas de las grandes fábricas de cervezas se han establecido en zonas (Campana, Zárate y Lujan) debido a la presencia, a muy poca profundidad, del acuífero Puelche, cuyas aguas tienen características extraordinarias para la elaboración de cerveza.
Por último, desde mi punto de vista, debo decir que cualquier cervecero que quiera hacer una cerveza representativa del lugar en donde vive, debería utilizar, además de ingredientes de la zona, el agua local sin ningún tratamiento, excepto aquel tendiente a eliminar el cloro, elaborando los estilos que se vean favorecidos por ésta, pero no por esto debe dejar de modificar el agua, si desea hacer estilos diferentes…
PARAMETROS
Dureza del Agua
Antiguamente se definía la dureza del agua en función de su capacidad para precipitar el jabón. Cuanto más jabón requería el agua para producir espuma mayor era su dureza. Químicamente, se sabe que el agua dura es aquella que, en su composición, contiene un alto nivel de minerales disueltos, por lo general iones calcio (Ca2+) y iones magnesio (Mg2+), y en forma menos crítica, aluminio (Al3+) y el hierro (Fe3+).
Como hemos dicho anteriormente, la presencia de estos minerales depende, en gran medida, de las formaciones geológicas que el agua atraviesa en su camino al acuífero y de las características de este reservorio.
El agua de lluvia se acidifica con la absorción de CO2 de la atmósfera, favoreciendo la disolución de los carbonatos donde predomina la piedra caliza dando, como resultado, aguas con mayor dureza. Cuando el agua corre por formaciones graníticas, por ejemplo, esto no sucede y tenderá a ser blanda, indistintamente del grado de mineralización que pueda tener.
Por regla general podemos decir que los acuíferos de origen glacial producen agua dura o calcárea, mientras que los que tienen un lecho de roca producen agua blanda o sódica.
Genéricamente, la dureza se calcula a partir de la suma de las concentraciones (en miligramos) de calcio y magnesio por cada litro de agua y se puede expresar en concentración de carbonato de calcio (CaCO3).
Dz = 2,50 [Ca++] + 4,16 [Mg++]
[Dz]: Dureza (mg/l de CaCO3)
[Ca++]: Concentración de ion Ca++ expresado en mg/l.
[Mg++]: Concentración de ion Mg++ expresado en mg/l.
Los coeficientes que aparecen en la fórmula expresan las proporciones entre la masa molecular del CaCO3 y las masas atómicas respectivas: 100/40 (para el Ca++); y 100/24 (para el Mg++).
Dureza temporal
La dureza temporal o carbonática es aquella ocasionada por la alta concentración de bicarbonatos y carbonatos (de calcio y magnesio)
dureza temporal o carbonática es aquella ocasionada por la alta concentración de bicarbonatos y carbonatos (de calcio y magnesio)
El carbonato de calcio (CaCO3) es el responsable de la formación de incrustaciones de calcio (sarro). Con el aumento de la temperatura del agua se hace menos soluble y precipita en formando un sólido conocido como sarro, por eso es que se observa por lo general en sistemas de agua caliente y elemento de calentamiento. Sin embrago, cuando el agua es extremadamente dura también se puede formar sarro en tuberías de agua fría.
El agua a punto de ebullición contribuye a la formación de carbonato, por lo que el calcio precipitará en forma de carbonato de calcio y el magnesio en hidróxido de magnesio. Con este proceso se logra eliminar la dureza temporal. Otra forma de hacer esto es con la adición de hidróxido de calcio (Ca(OH)2).
Dureza permanente
La dureza permanente también conocida como residual o no carbonática es causada normalmente por la combinación de de iones de calcio Ca2+ y magnesio Mg2+ con iones cloruro (Cl-), sulfato (SO42-) y nitrato (NO32-). Es decir, por la presencia de sulfatos y/o cloruros de calcio y de magnesio en el agua.
Este tipo de dureza no puede eliminarse con un método simple como la agitación térmica (ebullición), sino que es necesario recurrir a procesos químicos, por ejemplo añadiendo carbonato de sodio y cal, o a filtros de ceolitas (naturales o artificiales) que absorben los iones metálicos que producen la dureza, y liberan iones sodio en el agua.
Dureza Total
Es la suma de la dureza temporal y la dureza permanente.
Unidades de dureza del agua
La dureza del agua puede expresarse de distintas maneras. Cuando la unidad es el grado alemán (dH), todos los componentes de la dureza del agua son determinados como CaO (óxido de calcio), de forma que, 1 dH equivale a 10 mg/litro de CaO.
Otra unidad usada es el grado francés, aquí todos los componentes se expresan como CaCO3 (carbonato de calcio), y en este caso, 10 mg/l de CaCO3 equivalen a 1 fH.
Similar al anterior, el grado ingles (eH) o grado Clark, refiere los componentes en CaCO3 pero de manera tal que, 1eH sea igual a 1 grain / gallon ingles de carbonato de calcio.
Por último, también se puede expresar partes por millón (ppm = mg/l), ya sea de carbonato de calcio o de óxido de calcio.
Las equivalencias entre las distintas unidades son las siguientes
1 dH alemán = 1,25 grados ingleses = 1,78 grados franceses = 1,04 grados americanos = 17,9 ppm (17,9 mg/l) de carbonato de calcio = 10 ppm (10 mg/l) de óxido de calcio.
Clasificación de la dureza del agua
|
Tipos de agua |
mg/l |
°fH |
ºdH |
ºeH |
|
Agua blanda |
≤17 |
≤1.7 |
≤0.95 |
≤1.19 |
|
Agua levemente dura |
≤60 |
≤6.0 |
≤3.35 |
≤4.20 |
|
Agua moderadamente dura |
≤120 |
≤12.0 |
≤6.70 |
≤8.39 |
|
Agua dura |
≤180 |
≤18.0 |
≤10.05 |
≤12.59 |
|
Agua muy dura |
>180 |
>18.0 |
>10.05 |
>12.59 |
Alcalinidad
La alcalinidad es el parámetro del agua que mide su capacidad para neutralizar ácidos.
Los bicarbonatos (CO3H-) son los compuestos que más contribuyen a laalcalinidad, puesto que se forman en cantidades considerables por la acción del CO2 sobre la materia básica del suelo. Otros componentes que influyen en la alcalinidad son los carbonato (CO3=), los hidróxidos (OH-) y en menor medida los fosfatos y otros ácidos de carácter débil.
La alcalinidad del agua es la suma de las concentraciones de los iones de carbonato, bicarbonato e hidróxidosque actúan como amortiguadores para resistir la caída de pH, manteniendo este valor muy estable gracias a que al absorber protones, tienen un efecto tampón o buffer.
Se mide en las mismas unidades que la dureza y está influenciada por el pH, la composición general del agua, la temperatura y la fuerza iónica.
La alcalinidad se corrige por descarbonatación con cal, tratamiento con ácido, o desmineralización por intercambio iónico.
Relación con el Ph
Hemos dicho que el tipo de alcalinidad presente depende del pH del agua.
- Si el pH es menos de 8.3 toda la alcalinidad es debida a bicarbonatos.
- Si el pH esta entre 8.3 y 10.6 el agua tendra alcalinidad de carbonatos y bicarbonatos.
- Si el pH esta por encima de 10.6 pueden estar presentes tanto carbonatos como hidroxidos.
Relación con la Dureza
La alcalinidad también está relacionada con la dureza del agua.
- Si la alcalinidad total excede la dureza total toda la dureza puede ser temporal o de carbonatos y la alcalinidad en esceso es debida al sodio.
- Si la alcalinidad y la dureza total son iguales la toda la dureza es carbonatos.
- Si la alcalinidad total es menor a la dureza total, la dureza de carbonatos es igual a la alcalinidad total y el exceso de dureza es permanente o no carbonatada.
La alcalinidad es de suma importancia para los cerveceros, fundamentalmente aquellos que elaboran sus cervezas puramente con granos malteados. Generalmente la alcalinidad del mash es un problema cuando el pH del empaste es superior a 5.3. Con una alcalinidad alta disminuye extracción de azúcares y aumenta la de taninos afectando negativamente el sabor de la cerveza.
Rangos de alcalinidad.
BAJA < 75
MEDIA 75 - 150
ALTA > 150
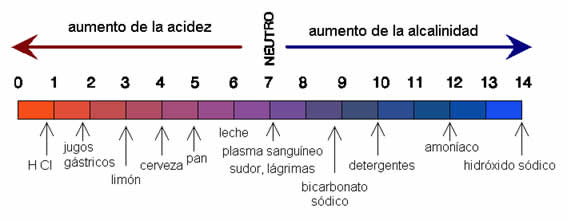
pH
La concentración de los iones de “hidronios” (H3O+) en una sustancia está indicada por un término químico conocido como “potencial de hidrógeno” (pH) y representada en una escala que va de 0 a 14, que mide la acidez o la alcalinidad de una solución. Los valores menores a 7 indicarán una solución ácida y mientras que una alcalina tendrá un valor mayor a ese número.
En la elaboración de cerveza, el pH del agua no es relevante. Lo realmente importante es el valor obtenido en el macerador luego de terminado el empaste, donde es necesario tener un pH que ronde los 5.3 para darle a las enzimas las condiciones óptimas de trabajo y obtener así mejores rendimientos minimizando la extracción de taninos astringentes de las cáscaras de los granos. Normalmente el agua tiene un pH en torno a 7 que disminuye al agregarle las maltas cuando se forma el empaste. Esto se debe a que la degradación enzimática de la fitina proveniente de la malta forma ácido fítico y fosfato de calcio o de magnesio, que precipitan separándose de la solución. La mayor parte del ácido fítico se combina con los iones libres de calcio (Ca +2) para dar origen a más fosfato de calcio. Esta reacción se ve favorecida por las temperaturas correspondientes al descanso ácido. Hay que tener en cuenta que las maltas oscuras tienen una mayor capacidad de acidificar el mash compradas con la más pálidas, por eso el uso de aguas muy duras permite la utilización de este tipo de maltas, contrarrestando el efecto de los niveles altos de bicarbonato y logrando un pH óptimo.
Cuando el agua usada es demasiado alcalina, este último proceso puede llegar a ser insuficiente y se deberá recurrir a la adición de algún ácido ( láctico o sulfúrico por ej.), pero siempre una vez realizado el empaste y controlado el pH general de la mezcla.
La forma de medir el pH es por medio de un Phmetro o con un test paper. El pH del agua cervecera (licor) adquiere importancia, sólo si la experiencia obtenida en una receta determinada, nos permite estimar el efecto que las maltas usadas producirán en el pH del empaste al finalizar la mezcla. Con este conocimiento se podrían realizar las correcciones necesarias, agregando sales o ácidos en el agua antes de que ingrese al macerador, pero siempre será mucho más precisa una medición en este último recipiente, luego de haber agregado todas las maltas. Es decir, corregir el pH una vez terminado el empaste.
COMPOSICION
Cuando hablamos de agua, en la elaboración de cerveza, debemos saber que ésta no es sólo una sustancia cuya molécula está formada por dos átomos de hidrógeno y uno de oxígeno (H2O). Hay en ella distintas sustancias disueltas entre las que encontramos varios minerales, algunos de importancia para el cervecero, otros no tanto.
La composición mineral del agua cervecera, tiene una influencia considerable tanto en el tipo como en la calidad de la cerveza producida y, en muchos casos, hace la diferencia entre un estilo y otro. Tal es esta influencia, que una misma composición de minerales puede causar efectos positivos o negativos, dependiendo del tipo de cerveza que se este elaborando.
Algunos de los elementos disueltos afectan directamente los procesos de producción por ejemplo la acción de las enzimas durante la maceración, la extracción del lúpulo y la precipitación de proteínas y taninos en el hervor y el crecimiento y el metabolismo de las levaduras en la fermentación. Otros no inciden en los procesos pero si se encuentran en grandes cantidades, pueden producir sabores o aspectos no deseados.
Calcio (CA+2)
Peso Atómico = 40.0
Peso Equivalente = 20.0
Rango de Fabricación = 50-150 ppm
Sin duda el calcio es uno de los elementos más importante en agua cervecera. Su presencia afecta varios aspectos en el proceso de elaboración de la cerveza.
Lo que provoca, fundamentalmente, es la disminución del pH del mosto, favoreciendo la actividad de la a-amilasa, ß-amilasa y proteasas, que son algunas de las enzimas más importantes, además de darle, al mosto y a la cerveza terminada, una mayor resistencia a la infección microbiológica.
Aumenta la producción de maltosa, haciendo así más fermentable el mosto..
Tanto en la maceración como durante la ebullición, el calcio beneficia la degradación y la precipitación de proteínas, fomentando la proteólisis, que además de reducir el nivel proteico en el mosto, aumenta la concentración de nitrógeno amino libre (FAN: Free Amino Nitrogen). en el mismo. Estos compuestos FAN son utilizados por la levadura durante la fermentación para la fabricación de aminoácidos, y un aumento en los niveles de éstos en el mosto mejora la salud y el vigor de la levadura.
Un alto nivel de proteínas en la cerveza también tiene efectos negativos, por ejemplo causando turbidez y en particular el chill haze. La vida útil del producto final también se puede ver afectada negativamente por esta cuestión.
En el sparging, el pH bajo del agua reduce la extracción de silicatos indeseables, taninos y polifenoles de la cama de grano que resultarían en sabores ásperos, turbidez y disminución de la estabilidad de la cerveza.
También en el macerador y en la caldera, el calcio precipita oxalatos como oxalato cálcico insoluble que , de no retirarse, pueden causar turbidez en la cerveza terminada y contribuir a la formación de incrustaciones en fermentadores, barriles y otras partes del equipo.
La presencia de calcio disminuye, en el sparging, la extracción de compuestos formadores de color tales como antocianidinas y proantocianidinas reduciendo la formación de color luego en la caldera.
Durante la fermentación, los iones del calcio propician la floculación de levadura. Cargados positivamente, estos iones, atraen las células de levadura cargadas negativamente y forman pequeñas agregaciones que sedimentan más fácilmente.
Pero no todas son ventajas. La disminución en el pH provoca una disminución en la utilización de lúpulo, dando cerveza menos amarga y aumentando los costos lupulización, debido a que más lúpulo será necesario para alcanzar el nivel deseado de amargura.
Gran parte del calcio añadido al macerador se pierde (precipitó como fosfato, proteinato u oxalato) y como este compuesto se requiere en la olla de hervor específicamente para precipitar esos materiales es común hacer una segunda adición durante la ebullición, pero si no resulta práctico es aceptable realizar una adición más grande en la molienda o en el tanque de preparado de agua…
Magnesio (Mg+2)
Peso Atómico = 24.3
Peso Equivalente = 12.1
Rango de Fabricación = 10-30 ppm
El magnesio se comporta de manera muy similar al Calcio en el agua, pero con menor eficacia, contribuyendo también a la dureza de la misma.
Es un elemento esencial del agua cervecera porque es necesario para lograr un comportamiento óptimo de la levadura, actuando como cofactor para la producción de ciertas enzimas necesarias para el proceso de fermentación. Cuanto mejor el "fermento de la levadura", es mejor el alcohol producido.
Se usa en el tratamiento del agua cervecera en niveles relativamente bajos, teniendo en cuenta, entre otras cosas, que en exceso puede interferir con las reacciones del calcio porque sus fosfatos son más solubles, que por encima de 30 mg/l puede dar a la cerveza un sabor agrio y amargo y que concentraciones altas (125 ppm) tiene un efecto diurético-laxante.
Muchos expertos desaconsejan las adiciones de magnesio, principalmente si se va a hacer una lager pero, de ser necesario, se puede incrementar este ión mediante la adición de Sales de Epsom.
Sodio (Na+1)
Peso Atómico = 22.9
Peso Equivalente = 22.9
Rango de Fabricación = 0-150 ppm
Normalmente el sodio está presente en la mayoría de las cervezas, pudiendo aparecer en concentraciones altas, en especial si se recurre a un tratamiento a base de sales para ablandar el agua cervecera. Por lo general no se aconseja ablandar el agua para la maceración debido a que, con seguridad, el calcio que ésta contiene será más necesario que el sodio.
En niveles óptimos contribuye al cuerpo y la sensación en la boca de la cerveza, redondea los aromas y acentua la dulzura de la malta, pero en concentraciones altas imparte un sabor amargo y salado totalmente indeseable. en altas concentraciones. Cuando el nivel de sulfato en el agua es alto, el sodio produce un amargor demasiado marcado, por lo que se debe mantener, siempre uno de estos iónes (preferiblemente el sodio) tan bajo como sea posible.
Para las ales más oscuras se recomiendan niveles más altos de sodio (cercano a 150 mg/l ) mientras que para lager y cervezas palidas se busca la más baja concentración que se pueda conseguir.
En todos los caso debemos saber que el sodio es siempre nocivo para la levadura.
Sulfato (SO4-2)
Peso Molecular = 96.0
Peso Equivalente = 48.0
Rango de Fabricación = 50-150 ppm para cervezas normalmente amargas,
150-350 ppm para cervezas muy amargas.
Al igual que los 2 iones anteriores (Ca y Mg ) contribuye a la dureza permanente y a bajar el pH. Es el principal elemento del agua que influye sobre la cantidad de lúpulo porque resalta un amargor seco y agudo cuando los IBUs son muy elevado. En concentraciones mayores a 400 ppm, el amargor resultante puede resultar desagradable y arruinar la cerveza. Los niveles mas bajos (menos de 10 mg/l ) son recomendados para las Pilsners, mientras que para la mayoría de las lager se aconseja valores de entre 25 – 50 mg/l a excepción de las de Dortmund y Vienna (100 – 130mg/l).
Para casi todas las ales se buscan niveles de de 30 – 70 mg/l, salvo para las pale ales de Burton-on-Trent (500-700 mg/l).
da a la cerveza un sabor más seco y amargo, y el otro (cloruro) le imparte plenitud y un grado de dulzura. Lo que se debe tener en cuenta es la relación entre ambas concentraciones y no cada una por separado. Por ejemplo, para una cerveza amarga, una relación 2:1 entre sulfato y cloruro será igualmente correcta, tanto para una concentración de 500:250 mgs/l como para otra de 350:175 mgs/l…
Se recomiendan proporciones de 1:2 (sulfato: cloruro) para ales menos amargas, mientras que una de 1:3 puede dará mejores resultados en las stouts o las porters.
El azufre es esencial para el proceso de fermentación, ya que la levadura necesita fabricar dos aminoácidos que contiene el azufre, la cisteína y la metionina. Algunas cepas de levadura utilizarán azufre de los iones sulfato para este propósito y luego excretan cualquier exceso en forma de iones de sulfito. Estos pueden reducirse a dióxido de sulfuro o sulfuro de hidrógeno teniendo, ambos compuestos, un característico olor pungente que incluso a niveles bajos pueden aromas sulfurosos inaceptables en la cerveza.
Algunas bacterias también tienen la capacidad de producir una amplia variedad de sabores sulfurosos como a goma, ajo o vegetales cocinados.
Cloruro (CI-1)
Peso Atómico = 35.4
Peso Equivalente = 35.4
Rango de Fabricación = 0-250 ppm
El ión de cloruro, en pequeñas cantidades Acentúa los sabores a malta y la percepción del sabor dulce. También aumenta la sensación en boca y nariz, la complejidad y la estabilidad de la cerveza y mejora su clarificación. En concentraciones altas, por sobre 300 ppm (generalmente en agua clorada o por residuos de lavandina usada como desinfectante), pueden producir aromas y sabores a remedio o a plástico debido a los componentes de clorofenol.
Las cervezas de densidades más altas soportan niveles mayores de cloruro (hasta 350 ppm)
Bicarbonato (HCO3-1)
Peso Molecular = 61.0
Peso Equivalente = 61.0
Rango de Fabricación = 0-50 ppm para cervezas más rubias, 50-150 ppm para las intermedias con algo de malta tostada, 150-250 ppm para las más oscuras.
Los iones de carbonato en general tienen una gran influencia en la química del agua cervecera. El Carbonato (CO3-2) es un ión alcalino que al elevar el pH, neutraliza la acidez caracteríticas de las maltas mas oscuras. El Bicarbonato tiene la mitad de la capacidad "buffering" que el CO3-2 , y es la principal forma de carbonatos en agua con un pH menor a 8.4 por lo que se debe controlarse muy de cerca para lograr buena cerveza. Los altos niveles de bicarbonato causan altos valores de pH durante el proceso, haciendo que todas las ventajas derivadas de la presencia de niveles adecuados de calcio y reducción pH se pierdan.
En concentraciones mayores a las recomendadas se obtendrá:
- Un retrogusto áspero en la cerveza terminada.
- El extracto se reducirá debido a la menor actividad ß-amilasa
- La fermentación será más pobre debido a la reducción de los niveles de FAN.
- Se dificulta la precipitación de proteínas debido al alto pH.
- El mosto y la cerveza se harán más propenso a infecciones.
- Habrá una mayor extracción de materiales indeseables en el sparging, particularmente, silicatos, polifenoles y taninos, disminuyendo la estabilidad y vida útil de la cerveza y aumentando la probabilidad de turbidez. El color será más oscuro y el sabor se verá afectado negativamente.
- La utilización del lúpulo será incrementada, dando más cerveza amarga
Cabe señalar que los iones de bicarbonato son bastante más eficaces para elevar pH del mosto que lo que los iones de calcio son para reducirlo. Es entonces esencial asegurar el retiro del exceso de bicarbonato antes de realizar el empaste. Un agua dura puede contener 250 mg/l de bicarbonato y el nivel máximo que puede tolerarse sin efectos adversos para la producción de las cervezas más pálidas es de 50 mg/l, pero lo ideal sería obtener alrededor de 25 mg/l.
Mientras que la adición de calcio puede hacerse tanto en olla del agua como en la molienda o en la caldera, la eliminación del bicarbonato debe hacerse en el tanque de agua o licor caliente. Esto se puede hacer de varias maneras:
Desionisación: Muy eficaces, pero altos costos de capital e ingresos.
Tratamiento de la cal: adición de cantidades cuidadosamente controladas de cal (hidróxido de calcio) en la olla de agua precipitará el bicarbonato como carbonato de calcio. Hay 2 grandes inconvenientes:
- La cantidad añadida debe ser calculada exactamente y además puede causar un aumento general en alcalinidad.
- El carbonato de calcio precipitado puede formar un residuos en el fondo del tanque que va a necesitar una limpieza periódica.
Punto de ebullición: Esto es un método tradicional de eliminación de bicarbonato (dureza temporal) pero nuevo tiene 2 inconvenientes:
- Muy caro.
- Sólo es efectivo si la alcalinidad está presente como bicarbonato. Si los niveles de carbonatos o hidróxidos de sodio, potasio o magnesio presentes son significativos la ebullición no será eficaz.
Tratamiento con ácido: Es ahora el más ampliamente utilizado de los métodos, por una serie de razones:
- Relativamente barato.
- Fácil de utilizar y no produce residuos en el tanque de agua.
- Agrega aniones deseables - sulfato o cloruro.
- Puede utilizar ácido fosfórico o láctico si los aniones no son deseados - eg para Lagers
Es fundamental para revolver le agua cuando se usa el tratamiento ácido para favorecer la eliminación del dióxido de carbono.que puede tener efectos corrosivos sobre los materiales de construcción del tanque si se deja en solución.
Dilución: Es el método más fácil de producir agua de bajo carbonato. Se usa agua destilada en una proporción de 1:1, lo que reducirá el nivel de bicarbonato a la mitad, aunque habrá una diferencia menor debido a reacciones buffering.
Potasio
El potasio como el magnesio, es un cofactor de la levadura y se requiere en niveles de trazas para fermentaciones satisfactorias. Es más aceptable que el sodio desde un punto de vista de sabor, dando un sabor salado sin las notas amargas y también desde el punto de vista de la salud ya que su ingesta no afecta la presión arterial. Sin embargo, sales de potasio son mucho más caras que los equivalentes de sodio y en exceso de potasio tiene efectos laxantes.
Nitrato
Ciertos productos químicos inorgánicos como los nitratos y nitritos pueden afectar tu cerveza, pero éstos no son un problema, salvo que utilice agua de dudosa procedencia. Si ves a niveles por encima de 5 ppm, deberías encontrar una fuente alternativa de agua.
Los niveles de nitrato están empezando a caer generalmente debido a un mayor control sobre el uso de abonos nitrogenados. Los nitratos en si no son un problema a niveles por debajo de 50 mg/l, sin embargo pueden ser reducidos por levaduras o algunas bacterias para formar nitritos que entonces pueden reaccionar con las aminas del mosto para formar nitrosaminas, que son cancerígenas.

Otros componentes
Además de cloro y los pocos iones mencionados anteriormente, hay varios otros componentes del agua que puedan afectar el sabor.
Generalmente, hay pequeñas cantidades de todo tipo de productos químicos desagradables en nuestro suministro de agua, pero son insignificantes y no tendrá un efecto sobre la cerveza.
Algunos productos químicos como cobre, hierro, manganeso y zinc son totalmente indeseables en el agua cervecera y deben estar presentes en cantidades inferiores a 1 ppm. Estos niveles son aceptables y hasta beneficiosos para la levadura porque inhiben la floculación prematura que resulta indeseable por producir fermentaciones interrumpidas. En mayor concentración pueden causar turbidez y sabores metálicos, en particular el hierro.
No hay que preocuparse por las cañerías cobre y plomo en la cervecería; los metales no se disuelven en el agua. Sí, en cambio, como es el caso del plomo, lo hacen en soluciones ácidas por lo que no se aconseja el uso de utensilios de este material en la elaboración de cerveza.
La mayoría los suministros de agua municipales está fluorados pero los niveles encontrados en el agua no afectarán a la cerveza.
Los metales pesados en concentraciones altas perjudican la fermentación porque pueden resultar tóxicos para las levaduras.
El Sílice también debe estar en niveles muy bajos en el agua cervecera cerveza (licor) debido a la probabilidad de formar turbidez coloidal.
El Amoníaco debe estar ausente en el agua de elaboración ya que es un indicativo de contaminación por aguas residuales.
TRATAMIENTO
 Antiguamente era común que cada aldea o incluso cada familia produjera su propia cerveza. Dado que las fuentes de agua estaban contaminadas la mayoría de las veces, la gente bebía cerveza, llegando a consumir, por persona, seis veces más que en la actualidad.
Antiguamente era común que cada aldea o incluso cada familia produjera su propia cerveza. Dado que las fuentes de agua estaban contaminadas la mayoría de las veces, la gente bebía cerveza, llegando a consumir, por persona, seis veces más que en la actualidad.
Al hervir el agua para fabricar cerveza, la purificaban sin darse cuenta, convirtiendo a la cerveza en un alimento seguro y que además tenía buen gusto y alegraba el espíritu ante las horribles enfermedades que azotaban la época, una de ellas fue la peste negra.
Actualmente la situación es similar a la de la Edad Media, los ríos, lagos y acuíferos no son tan puros como lo fueron en otras épocas.
Pero hoy los contaminantes son otros, más de origen artificial que natural y mientras que antes eran focos eventuales y localizados, hoy la situación es crónica en muchos lados,. En la antiguedad, casi la totalidad de los contaminantes eran de origen natural, organismos patógenos como bacterias y virus; parásitos tales como protozoos microscópicos y gusanos o bien toxinas como el altamente venenoso metal arsénico. Hoy aún existen estos contaminantes pero los conocimientos y las prácticas de buenas medidas sanitarias y de higiene ayudan a controlar cualquier propagación desmedida.
El progreso trajo aparejado otro tipo de contaminación, una que se debe fundamentalmente a productos fabricados por la mano del hombre para uso industrial y agrícola, incluidos los metales pesados como plomo y mercurio, además de sustancias y compuestos químicos peligrosos como insecticidas y fertilizantes para el campo. También la lluvia que atraviesa nuestra atmósfera cada vez más contaminada colabora con la pérdida de pureza de las fuentes de agua.
La diferencia entre aquellas épocas y ésta es que ahora es posible el tratamiento del agua alterando de manera artificial sus características. Este procedimiento no sólo logra purificar el agua sino que permite variar la composición química del agua para adaptarla a los diferentes estilos, salvando así las limitaciones que impone la ubicación geográfica del agua que le da origen a cada uno de esos estilos. Aún así, algunos consumidores exigentes aseguran que las cervezas elaboradas actualmente con el agua de la fuente original, continúan manteniendo la calidad, el sabor y el aroma característicos y únicos de la región.
El tratamiento del agua consiste en eliminar cualquier contaminante, químico o biológico y en alterar las concentraciones de distintas sales para imitar las características de cualquier región del mundo.
Por regla general un agua que sea potable, es decir apta para consumo humano, siempre servirá para la elaboración de cerveza.
Las aguas superficiales requieren menos tratamiento que las aguas subterráneas pero, normalmente, las plantas convencionales de tratamiento, utilizan una secuencia de procesos más o menos estándar para convertir dichas aguas en agua de red, apta para consumo humano.
La mayoría de las grandes cervecerías usan hoy, directamente el agua de red de la ciudad en donde están asentadas asegurándose con esto un agua libre de contaminantes peligrosos. Aunque teóricamente debiera ser así no deberían dejar de hacer controles al respecto, más aún si se trata de países en vías de desarrollo donde las tecnologías y los procesos no están todos disponibles.
De lo único que tienen que preocuparse entonces esas empresas es de eliminar los olores y sabores indeseables, productos de algunos gases disueltos (cloro, cloramina, etc) y de ajustar la concentración de ciertos minerales para adaptarla a la cerveza que desean elaborar.
A nivel cervecero casero (homebrew) pasa exactamente lo mismo, variando solamente los métodos y la tecnología que se usan.
Sería ideal que el agua base que se vaya a utilizar tenga un contenido pobre de minerales que permita ser tratada fácilmente y obtener así el agua perfecta para cualquier estilo de cerveza que se desee elaborar. Si, en cambio, el agua contiene demasiados minerales estos deben ser eliminados o reducidos mediante diferentes métodos, ya sean técnicos o químicos, para luego adaptar los niveles a los requerimientos exactos de cada cocción.
Eliminación del cloro
Para inhibir cualquier crecimiento microbiano, las plantas de tratamiento le agregan generalmente cloro al agua corriente, aunque en algunos casos hacen uso de la cloramina.
Es muy importante la eliminación de cualquiera de estos dos productos para obtener una cerveza de calidad con buen gusto y aroma.
El cloro se elimina fácilmente por ebullición o dejando reposar el agua toda una noche. Este método no es muy práctico para las grandes cervecerías y es usado principalmente por cerveceros caseros. Otra forma de deshacerse del cloro es haciendo pasar el agua por filtros de carbón activado. Estos filtros no son muy caros y remueven, además, la mayoría de los olores y mal gusto producidos por gases disueltos y sustancias orgánicas. Las cloraminas que no pueden eliminarse por ebullición así que es necesario el uso de los filtros mencionados. Agregando una pastilla campden (Potasio Metabisulfato ) cada 76 litros se obtienen los mismo resultados.
Eliminación de minerales
El exceso de minerales en el agua le otorga sabores metálicos desagradables para el paladar (a hierro, cobre o magnesio por ej.), además de dejar incrustaciones de sarro en las cañerías. Para evitar esto se debe disminuir la concentración de minerales disueltos para lo cual conviene airear, hervir, y dejar enfriar toda una noche el agua que se va a utilizar en la elaboración. De esta manera el exceso de minerales se deposita en el fondo de la olla. Antes de su utilización se debe pasar el agua a otro recipiente tratando que los minerales depositados queden en el primero.
Los sistemas para ablandamiento de agua pueden también eliminar los sabores metálicos. Los a base de sales funcionan reemplazando los metales pesados por sodio a través del intercambio de iones.
Ablandar el agua puede alterar el balance de minerales necesarios en el proceso de maceración, por eso es muy importante el uso controlado de sistemas de ablandamiento cuando se va a elaborar cerveza mediante el método tradicional (all-grain). No es tan así cuando se fabrica a base de extractos.
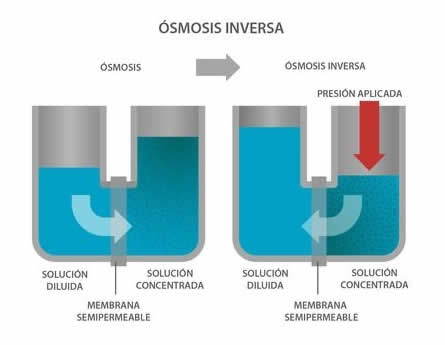
Ósmosis inversa
La ósmosis inversa es un sistema para tratar el agua que originalmente se usaba exclusivamente para desalinizarla. Los avances tecnológicos permitieron que hoy, no sólo se logre eliminar la mayoría de los minerales sino que también se puedan remover microorganismos, partículas y materiales orgánicos naturales que contaminan el sabor del agua y afectan su claridad.
Consiste en láminas delgadas de un material que permite que las moléculas de agua pasen a través de ella, reteniendo otras sustancias en suspensión.
El flujo natural entre dos sustancias llamado “ósmosis” hace que la más diluida fluya hacia la de mayor concentración, pero en estos sistemas se presuriza la solución a tratar (más concentrada) de tal manera que el proceso se invierte, de ahí la denominación de “ósmosis inversa”.
Cuando el contenido de algunos elementos como el hierro, el cloro y el manganeso es alto es muy posible que el agua requiera algún tratamiento previo a la ósmosis inversa.
El gran problema que surge de la utilización de este sistema es la cantidad del producto de desecho, salobre y con todos los contaminantes retenidos. El volumen de este concentrado puede ser hasta un 50 % del volumen total del agua a tratar y su eliminación debe ser controlada a conciencia para minimizar las consecuencias ambientales.
La siguiente cosa importante a saber es que el resultado de la ósmosis inversa no es tan puro como la destilación pero reduce los niveles de iones en el agua en una proporción aproximada de 9 a 1. Así que si el agua tenía 300 ppm de calcio por ejemplo, después de tratada tendrá cerca de 33 ppm. Por eso es importante saber el contenido mineral del agua inicial, de esa manera se podrá calcular correctamente las adiciones de minerales que se deben hacer para obtener el tipo de agua ideal para la cerveza que se va a elaborar.
Alcalinidad residual y pH del mash
Hemos dicho anteriormente que lo importante, en la elaboración de cerveza, no es el pH del agua usada (licor) sino el pH obtenido en el macerador luego de que ésta se mezcle con la malta. Este último valor dependerá de la composición mineral del agua y conociendo la concentración de iones de calcio, magnesio y la alcalinidad se podrá estimar el pH probable de su mash realizando algunos cálculos o por métodos empíricos….
A mediados del siglo XX, Paul Kohlbach describe lo que se conoce como Alcalinidad Residual (AR) y demuestra que durante la maceración el calcio y el magnesio reaccionan con los compuestos fosfatados de la malta produciendo ácidos que neutralizan la alcalinidad del agua.
Determinó que 3.5 equivalentes de Calcio reaccionan con la Fitina presente en la malta liberando 1 equivalente de hidrógeno, neutralizando así 1 equivalente de alcalinidad del agua. El Magnesio actúa de forma similar pero en menor medida, necesitando 7 equivalentes para neutralizar el mismo nivel de alcalinidad. Toda la alcalinidad que queda sin neutralizar es la llamada "Alcalinidad Residual" (RA).
La alcalinidad residual es un parámetro importante a tener en cuenta en la elaboración de cerveza en especial para evaluar la conveniencia del agua a utilizar. Se calcula con la fórmula siguiente conociendo las concentraciones de calcio, magnesio y la alcalinidad, expresadas de igual modo, pudiendo ser todas en meq/L (miliequivalente por litro) o todas en ppm ( partes por millón).
AR = Alcalinidad – ( Calcio / 3.5 + Magnesio* 7 )
Conociendo el valor de la alcalinidad residual se entenderá mejor la interacción entre la alcalinidad y la dureza del agua y los efectos en el proceso de maceración. El diagrama que sigue, basado en el trabajo de A.J. Delange, representa la Alcalinidad, la Dureza Efectiva y la Alcalinidad Residual (líneas diagonales).
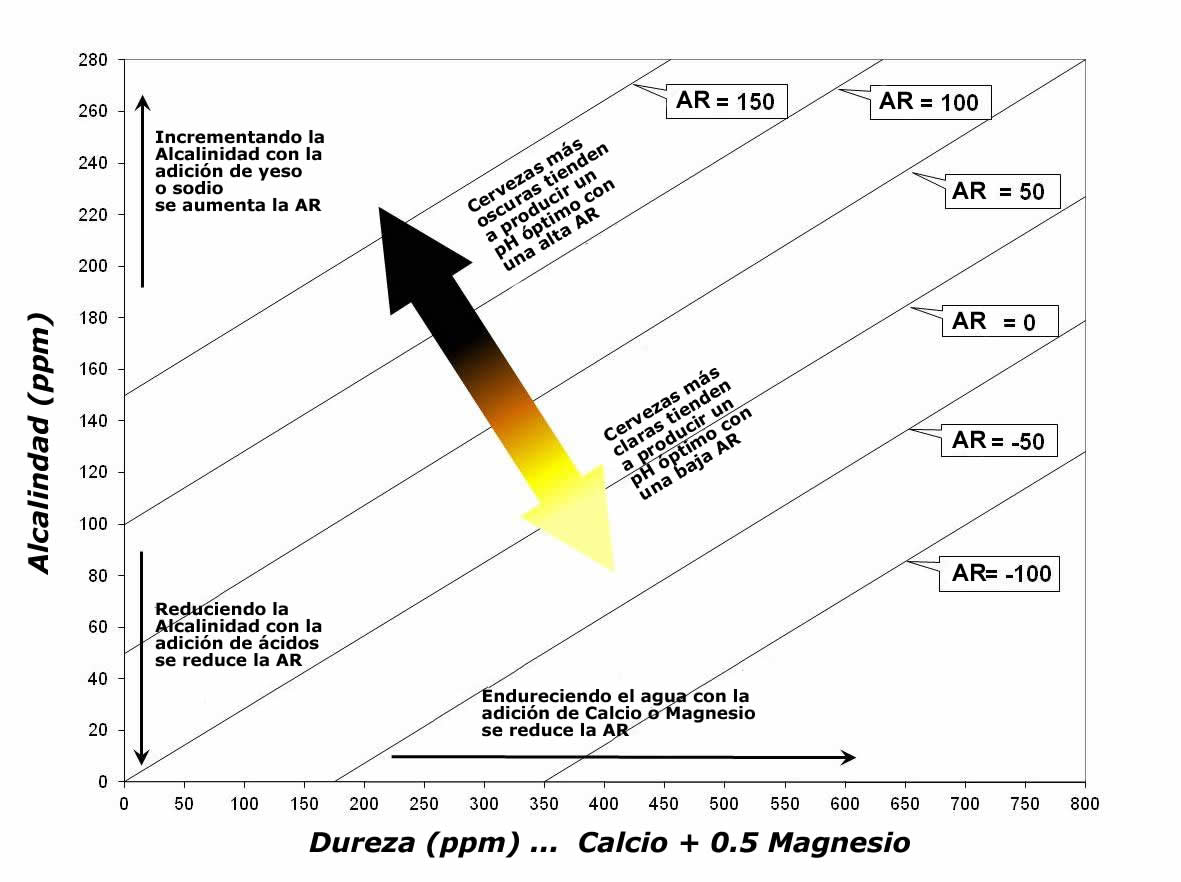
En una producción a base de solo malta (all grain) la alcalinidad residual hará que el pH del mosto en la maceración sea más alto que lo deseable, causando, entre otras cosas, una mayor extracción de taninos. En zonas con aguas alcalinas, los fabricantes encontraron la agregando maltas oscuras que, por tener una acidez natural, le devuelven al mosto el pH apropiado.
Para poder determinar la alcalinidad residual y saber aproximadamente qué pH tendrá un mosto all grain y corregirlo de ser necesario, John Palmer en su libro “ How to Brew” (http://www.howtobrew.com ) describe el siguiente diagrama desarrollado por él mismo.
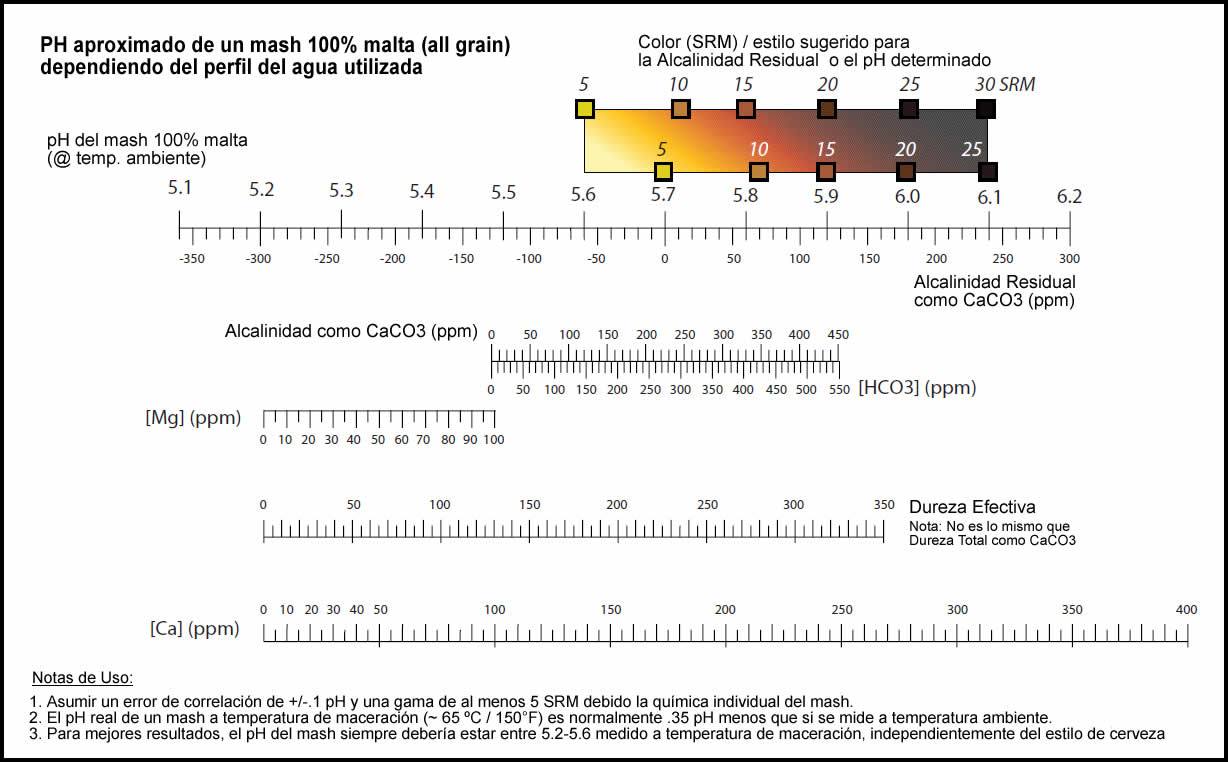
Para detallar el uso de este diagrama nada mejor que la versión del mismo autor. Mientras que la explicación original (en inglés) podrán encontrarla aqui, transcribo a continuación la versión en español traducida por un grupo de cerveceros argentinos.
“…. Para usar el diagrama, marcar los niveles de calcio y magnesio para determinar una "efectiva" dureza (EH), dibujar luego una línea desde ese valor a través de su valor de alcalinidad, para señalar la RA y el pH aproximado.
Después de determinar su probable pH, el diagrama le ofrece 2 opciones:
- Fabricar un estilo que coincida aproximadamente con el pH de la escala.
- Estimar la cantidad de calcio que debería agregarse para lograr el pH buscado.
Mostraré cómo funciona esto en el ejemplo siguiente:
Determinación de los estilos de cerveza que mejor se adaptan a su agua
- Un reporte de agua de Los Ángeles, CA, determina que las tres concentraciones de iones son:
Ca (ppm) = 70
Mg (ppm) = 30
Alcalinidad = 120 ppm como CaCO3
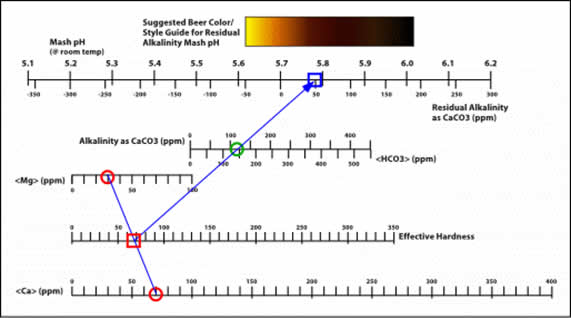
- Marcar estos valores en las escalas apropiadas. (Marcadas aquí con círculos rojos y verdes)
- Dibujar una línea entre los valores de Ca y Mg para determinar la Dureza Efectiva. (Señalada con un cuadrado rojo).
- A partir de este valor de Dureza Efectiva (EH), trazar una línea a través del valor de Alcalinidad (círculo verde), hasta la intersección de la escala RA/pH. Ese es el pH estimado de su mash (cuadrado azul).
- Mirando directamente por encima de la escala del pH, la guía de color muestra una sombra medianamente clara, que corresponde a la mayoría de las amber, red y brown ales, y lagers. La mayoría de las recetas de las Pale Ale, Brown Ale y Porter pueden fabricarse con confianza.
Determinación de las adiciones de calcio para bajar el pH del mash
Qué ocurre si se quiere fabricar una cerveza mucho más pale, como una Pilsener o una Helles. Se debe agregar mucho más calcio para balancear la alcalinidad que no puede balancear la malta elegida.
- Vuelva al gráfico y marque un punto en la escala de pH que esté dentro del rango de color deseado. En este ejemplo, se eligió un valor de alrededor pH 5.6.
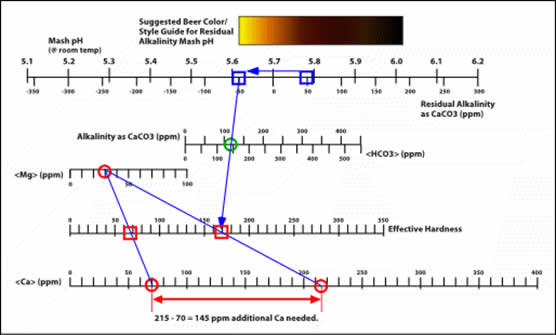
- Trace una línea desde este valor de pH a través de su valor de alcalinidad (del reporte de agua), y determine su nuevo valor EH.
- A partir del valor original de Mg del reporte, trace una línea a través del nuevo valor EH, y determine el nuevo valor de Ca necesario para producir esta dureza efectiva (EH).
- Reste el valor original de Ca al nuevo valor de Ca, para determinar la cantidad del mismo (por galón) que es necesario agregar. En este ejemplo, es necesario agregar 145 ppm/gal. de calcio adicional.
- La fuente de calcio puede ser tanto calcium chloride o calcium sulfate (gypsum).
Ver la sección siguiente para conocer las cantidades a agregar de cada una de estas sales.
Determinación de las adiciones de bicarbonato para elevar el pH del mash
De la misma forma, se puede determinar la alcalinidad adicional (HCO3) necesaria para fabricar una dark stout cuando el agua es de baja alcalinidad.
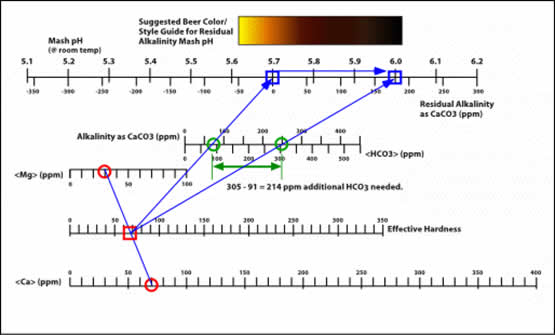
Figura 8: Gráfico para determinar el pH aproximado de su mash, a partir del reporte de agua local.
- A partir del pH inicial del mash tomado del reporte de agua, determine el pH deseado para el estilo de cerveza que desea fabricar. En este ejemplo, se seleccionó un pH de 6, que corresponde a una dark beer en la guía de color.
- La diferencia es que esta vez se traza una línea desde el pH deseado hasta la EH original, pasando a través de una nueva alcalinidad.
- Restar la alcalinidad original a la nueva alcalinidad para determinar la cantidad adicional de bicarbonato requerida. El bicarbonato adicional puede agregarse ya sea usando bicarbonato de sodio (baking soda - polvo de hornear), o carbonato de calcio. El uso de carbonato de calcio agregado también puede afectar la EH, haciendo que se deba re-evaluar todo el sistema; el uso de baking soda, en cambio, contribuiría a elevar los niveles de sodio, lo cual, en grandes cantidades, puede producir aromas indeseados. Lo que se desea es agregar uno u otro para lograr el nivel de bicarbonato buscado, sin agregar demasiado sodio o calcio.
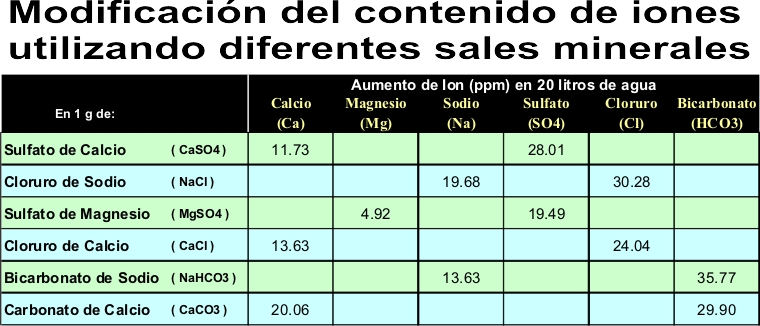
15.4 Uso de sales para ajuste de agua de fabricación
El agua de fabricación puede ajustarse (hasta cierto punto) mediante el agregado de sales de fabricación. Lamentablemente, el agregado de sales no es una cuestión de 2+2 = 4; tiende a ser 3.9 o 4.1. La química del agua suele ser complicada, las reglas tienen excepciones y umbrales en los cuales dominan otras reglas y excepciones.
Afortunadamente, para la mayoría de las aplicaciones prácticas no es necesario ser tan riguroso. Se pueden agregar al agua los iones que necesita con sales que se consiguen fácilmente. Para calcular cuánto agregar, usar la monografía de otro grafico de agua para calcular qué concentración es la deseable, y restar después la concentración de iones de su propia agua para determinar la diferencia. Luego consultar la Tabla 16 para ver la cantidad de iones de una sal en particular que es necesario agregar. No olvidarse de multiplicar la diferencia en concentración por el volumen total de agua que se está usando.
Volvamos a ejemplo de la monografía donde se determinó que era necesario agregar 145 ppm iones de calcio adicionales. Se usaron 15,14 litros de agua para el mash.
- Elegir una sal para agregar el calcio necesario. Se usará gypsum.
- Según la Tabla 16, gypsum agrega 61.5 ppm de Ca por gramo de gypsum agregado a 3,79 litros de agua.
- Dividir los 145 ppm por 61.5 para determinar los gramos de gypsum necesarios por galón para lograr la concentración deseada. 145/61.5 = 2.4 gramos
- Después, multiplicar la cantidad de gramos por galón por el número de galones en el mash (4)….. 2.4 x 4 = 9.6 gramos, que pueden redondearse a 10 gramos.
- A menos que se tenga a mano una escala en gramos, habrá que convertir los gramos en cucharadas de té, lo cual es mucho más conveniente. Hay 4 gramos de gypsum por cucharada, lo cual da: 10/4 = 2.5 cucharadas de gypsum que habrá que agregar al mash.
- Finalmente, es necesario saber cuánto sulfato ha producido esta adición. 2.5 gramos por galón equivalen a 368 ppm de sulfato agregados al mash, lo cual es una gran cantidad. En este caso, sería una buena idea usar calcium chloride para la mitad de la adición.
La tabla siguiente provee información sobre el uso y resultados de cada adición de sales. Estas deben usarse en poca cantidad para corregir graves deficiencias o sobreabundancia de iones. Las concentraciones dadas en Tabla 16 son para 1 gramo disuelto en 1 galón de agua destilada. La disolución de 1 gramo de una sal en su agua resultará en un valor diferente, debido a su específico pH y contenido de minerales. De todas maneras, los resultados deberían ser razonablemente cercanos. Por favor consultar el Apéndice F - Lecturas Recomendadas, para encontrar más información que la que se brinda aquí sobre la química del agua y ajuste del agua de fabricación.
Tabla 16 - Sales para el ajuste del agua
|
Nombre común de la sal |
Concentración |
Gramos por cucharada té al ras |
Efecto |
Comentarios |
|
Carbonato de Calcio (CaCO3) a.k.a. Tiza |
105 ppm Ca+2 |
1.8 |
Eleva el pH |
Debido a su limitada solubilidad sólo es efectivo cuando se lo agrega directamente al mash. Usado para cervezas negras en áreas de aguas blandas. Usar la monografía y controlar el pH del mash con pH test papers para determinar cuánto agregar. |
|
Sulfato de Calcio (CaSO4*2 H2O) a.k.a. Gypsum |
61.5 ppm Ca+2 |
4 |
Baja el pH |
Útil para agregar calcio si el agua es baja en sulfato. Puede usarse para agregar "dureza" de sulfato al amargor del lúpulo. |
|
Calcium Chloride (CaCl2*2H2O) |
72 ppm Ca+2 |
3.4 |
Baja el pH |
Útil para agregar Calcio si el agua es baja en Chlorides. |
|
Sulfato de Magnesio (MgSO4*7H2o) a.k.a. Epsom Salt |
26 ppm Mg+2 |
4.5 |
Baja el pH en pequeña cantidad |
Puede usarse para agregar "crispness" de sulfato al amargor del lúpulo. |
|
Bicarbonato de Sodio (Na HCO3) a.k.a. Braking Soda |
75 ppm Na+1 |
4.4 |
Eleva el pH al agregar alcalinidad |
Si su pH es demasiado bajo y/o tiene poca alcalinidad residual, ésta puede agregarse. Ver el procedimiento para carbonato de Calcio. |
El consejo final sobre el tema es que si se quiere fabricar una pale y el agua es muy alta en carbonatos y baja en calcio, lo mejor es usar agua envasada*, o diluir su agua con agua destilada y agregar gypsum o calcium chloride para compensar el déficit de calcio. Observar también las cantidades de sulfato y chloride. La disolución de minerales con agua no es tan fuerte como lo es la disolución en el mosto, debido al efecto de los varios iones buffering, pero será razonablemente aproximada. ¡Buena Suerte!
*Habría que conseguir el análisis del agua envasada llamando al fabricante. Yo lo he hecho con un par de marcas.
<---- *** ---->
CANTIDAD DE AGUA
La mayor parte del consumo de agua, en una cervecería, se usa para fines de limpieza y mantenimiento de la planta y convirtiéndose luego en aguas que se descartan por contener residuos de los químicos utilizados en esas tareas. La escasez cada vez mayor del recurso ha puesto en evidencia la importancia de economizar y aprovechar mejor el agua. El desarrollo de nuevas tecnologías y procesos más eficientes hizo que las cervecerías más modernas lleguen a usar el mismo volumen de agua para limpieza que el volumen de cerveza producida. Antiguamente esa relación resultaba imposible dado que las cervecerías eran menos eficientes y llegaban a usar hasta 8 veces esa cantidad.
Actualmente se puede decir que usar en total unos 4.5 - 5 litros de agua por cada litro de cerveza producida es un buen promedio para cualquier cervecería. De esa cantidad de 2 a 3 partes resultarían aguas residuales, 1 parte se perdería en el bagazo, por evaporación, en el fermentador y en otras partes del proceso y por último 1 parte sería el volumen del producto ( la cerveza) terminado. En realidad, este consumo pertenece sólo a la última fase de producción de una cerveza. Si a esto le sumáramos la cantidad de agua usada en los distintos procesos anteriores a la etapa de cocción, como la producción de grano y lúpulo y el malteado, el promedio mencionado sería bastante más alto.
Agua a tratar
 El agua a tratar es sólo una parte de la cantidad de agua que se precisa para elaborar una cerveza. Si bien en muchos lados ajustan la dureza del agua de limpieza para que los detergentes sean más eficientes, el agua que, salvo excepciones, siempre debe ser tratada es aquella que va a ser usada como ingrediente, es decir que va a formar parte del producto final.
El agua a tratar es sólo una parte de la cantidad de agua que se precisa para elaborar una cerveza. Si bien en muchos lados ajustan la dureza del agua de limpieza para que los detergentes sean más eficientes, el agua que, salvo excepciones, siempre debe ser tratada es aquella que va a ser usada como ingrediente, es decir que va a formar parte del producto final.
En las grandes cervecerías, el tratamiento de agua debe ser un proceso continuo, dado el constante requerimiento que la producción tiene de ésta, pero para los pequeños cerveceros, que no elaboran sus cervezas todos los días, saber de antemano qué cantidad de agua necesitan tratar para su cocción, le evitará sorpresas futuras, como tener que preparar más a último momento por tener de menos, o perder tiempo y energía preparando, por demás, agua que no se va a usar.
Para calcular correctamente la cantidad total de agua que se necesitará en todo el proceso, el cervecero debe tener en cuenta algunas variables como las siguientes…
• El volumen de cerveza que va a producir: Si se planea elaborar 20 litros de cerveza se usarán por lo menos 20 ltr de agua.
• El agua atrapada en el bagazo (los granos usados): La extracción de azúcares y proteínas hace que, al finalizar la maceración, el grano haya perdido parte de su peso. Si bien se puede calcular con mayor precisión, para fines prácticos, se asume que esta pérdida es del 60% del peso total de los granos agregados en el macerador. Esto significa que si se agregaron 10 kilos de grano para una receta, al finalizar la maceración habrán quedado 4 kilos de granos exhaustos.
Por otro lado se sabe que en el mismo proceso, los granos absorben cierta cantidad de agua que no se convertirá en mosto y que se estima es igual al 80 % del peso total del bagazo, el 20% restante corresponde a los granos usados.
Volviendo al ejemplo anterior, los 4 kilos de grano usado calculados, representan entonces el 20% del peso del bagazo, siendo el 80% restante el peso del agua retenida. Simplificando se puede decir que la cantidad de agua retenida será 4 veces el peso del grano al final de la maceración. En este caso sería 16 kilos de agua o lo que es lo mismo, 16 litros. Con la siguiente ecuación se podrá predecir cuanta agua quedará retenida en el bagazo:Litros retenidos = Peso del grano en kilos x 0,4 x 4 = Peso del grano en kilos x 0,16
• El agua evaporada durante el hervor : Para una mayor exactitud, en varias cocciones con un mismo equipo, el cervecero debería tomar nota, de la cantidad total de agua evaporada y dividirla por el tiempo que ha durado el hervor. Promediando los resultados obtendrá la tasa estimada de evaporación de su equipo. Este valor podrá variar, de un equipo a otro, dependiendo del volumen de producción y de la fuente de calor utilizada. Quién no haya podido medir cuanta agua evapora su equipo, podrá estimar un valor del 5% del volumen a hervir por hora, basándose en la experiencia de las grandes empresas cerveceras…
Una vez registrada la tasa de evaporación, en las cocciones posteriores, sólo queda multiplicarla por el tiempo de hervor proyectado para saber cuanta agua se perderá en esta parte del proceso.
Otra fuente de evaporación a tener en cuenta es el método de decocción, en el cual parte del mosto debe ser hervido durante la maceración. Para este fin habrá que estimar una cantidad extra de agua…• El agua atrapada en las distintas partes del equipo : Posiblemente esta cantidad se pueda estimar de una sola vez recogiendo, en cada paso de la elaboración, las pérdidas sufridas. Por ejemplo lo que queda en el fondo del macerador, en las mangueras, o lo que se desecha junto con los sedimentos.
Al final del proceso, el volumen recogido determinará qué cantidad de agua queda atrapada en el equipo usado. Una buena configuración de éste hará que la cifra obtenida sea casi nula.• disminución del mosto caliente mientras se enfría: Por último, queda tener en cuenta la reducción de volumen que sufre el mosto cuando se enfría. Esto se debe al cambio de la densidad del mosto a medida que baja la temperatura del mismo, llegando a tener un volumen un 4% menor cuando llega a los 20ºC.
De esta manera, con todas las variables contemplada, se puede estimar con buena precisión la cantidad de agua necesaria para una cocción sin contratiempos.
Pablo Gigliarelli
Fuentes:
- The Brewmaster Bible - Stephen Snyder,
- Water, a Comprehensive Guide - Palmer/ Kaminski
- Designing Great Beers - Daniels
- Tecnología para Cerveceros y Malteros - Kunze
- Brew Your Own



